
Pentachloorfenol
| Pentachloorfenol | |||||
|---|---|---|---|---|---|
| Structuurformule en molecuulmodel | |||||
| |||||
|
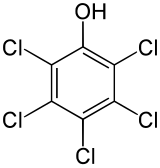
Structuurformule van pentachloorfenol
| |||||
| Algemeen | |||||
| Molecuulformule | C6HCl5O | ||||
| IUPAC-naam | 2,3,4,5,6-pentachloorfenol | ||||
| Andere namen | PCP | ||||
| Molmassa | 266,33654 g/mol | ||||
| SMILES |
C1(=C(C(=C(C(=C1Cl)Cl)Cl)Cl)Cl)O
|
||||
| InChI |
1/C6HCl5O/c7-1-2(8)4(10)6(12)5(11)3(1)9/h12H
|
||||
| CAS-nummer | 87-86-5 | ||||
| EG-nummer | 201-778-6 | ||||
| PubChem | 992 | ||||
| Beschrijving | Witte naaldvormige kristallen | ||||
| Waarschuwingen en veiligheidsmaatregelen | |||||
| |||||
| H-zinnen | H301 - H311 - H315 - H319 - H330 - H335 - H351 - H410 | ||||
| EUH-zinnen | geen | ||||
| P-zinnen | P260 - P273 - P280 - P284 - P301+P310 - P305+P351+P338 | ||||
| Carcinogeen | mogelijk (IARC-klasse 3) | ||||
| EG-Index-nummer | 604-002-00-8 | ||||
| VN-nummer | 3155 | ||||
| ADR-klasse | Gevarenklasse 6.1 | ||||
| LD50 (ratten) | (oraal) 27 mg/kg | ||||
| Fysische eigenschappen | |||||
| Aggregatietoestand | vast | ||||
| Kleur | wit | ||||
| Dichtheid | 1,978 g/cm³ | ||||
| Smeltpunt | 190-191 °C | ||||
| Kookpunt | (ontleedt) 309-310 °C | ||||
| Dampdruk | 0,008 Pa | ||||
| Oplosbaarheid in water | (bij 30°C) 0,020 g/L | ||||
| Goed oplosbaar in | aceton, benzeen, ethanol | ||||
| Slecht oplosbaar in | water | ||||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | |||||
| |||||
Pentachloorfenol, vaak afgekort tot PCP (van het Engelse pentachlorophenol), is een organische verbinding met als brutoformule C6HCl5O. De stof werd voor het eerste bereid in de jaren 30 van de 20e eeuw. De verbinding is onder een groot aantal namen op de markt gebracht, zoals: Santophen, Pentachlorol, Chlorophen, Chlon, Dowicide 7, Pentacon, Penwar, Sinituho en Penta. De stof wordt in twee vormen aangeboden: als het vrije fenol of als het natriumfenolaat. De laatste vorm is goed oplosbaar in water. Het gebruik van pentachloorfenol loopt van herbicide, via insecticide, fungicide, algicide en ontsmettingsmiddel tot anti-aanslagverf. De stof werd toegepast in combinatie met landbouwzaden (hoewel de betreffende gewassen dan niet voor consumptie bestemd waren), leerbewerking, metselwerk, hout, koelwater en papiermolens.
Sinds het begin van de jaren 80 van de 20e eeuw is de stof in de Verenigde Staten niet meer vrij te koop. Tegenwoordig wordt het in dat land nog voornamelijk gebruikt als conserveermiddel voor bielzen (bij spoorrails) of telegraaf- en elektriciteitspalen.
Het gebruik van pentachloorfenol levert de spoorwegen en telefoon- en elektriciteitsmaatschappijen een goede besparing op, omdat een onbehandelde biels of paal al na ongeveer 7 jaar vervangen moet worden. Een met PCP behandelde biels of paal gaat gemiddeld 35 jaar mee.
Inhoud
Synthese
Pentachloorfenol kan bereid worden door behandeling van fenol met chloorgas in aanwezigheid van een katalysator (aluminiumchloride of ijzer(III)chloride) bij temperaturen rond 190°C. Deze synthese verloopt in stappen en het is lastig alle uitgangsstof tot pentachloorfenol om te zetten. Commercieel verhandelde pentachloorfenol heeft daardoor meestal een gehalte tussen 84% en 90%. Tijdens het proces worden bovendien een aantal verontreinigingen gevormd, waaronder andere meervoudig gechloreerde fenolen, polychloordibenzo-p-dioxines en polygechloreerde dibenzofuranen. Een groot aantal van deze verbindingen is giftiger dan pentachloorfenol zelf.
Toxicologie en veiligheid
Voor mensen ligt het grootste risico van blootstelling aan pentachloorfenol vooral in de bedrijfsmatige sfeer. Het werken in een verontreinigde atmosfeer of huidcontact met pentachloorfenol vormen dan grote risico's. Ook contact met behandeld hout leidt tot blootstelling. Ook in het kader van volksgezondheid dient men bedacht te zijn op de stof. Vooral in de omgeving van bedrijven waar hout verduurzaamd wordt is het risico reëel.
Giftigheid
Kortstondige blootstelling aan grote hoeveelheden pentachloorfenol heeft schadelijke effecten op lever, nieren, maag, darmen, bloed, longen, het zenuwstelsel en immuunsysteem. Daarnaast zijn verhoging, zweten, ongecontroleerde bewegingen en coma ook als effect genoemd. Contact met pentachloorfenol-damp leidt tot geïrriteerde huid, slijmvliezen en ogen.
Langdurige blootstelling, zoals in fabrieken en werkplaatsen mogelijk is, leidt tot blijvende schade aan de genoemde organen. Ten slotte is pentachloorfenol in verband gebracht met carcinogene effecten. De EPA deelt de stof dan ook in onder groep B2 (mogelijk carcinogeen voor mensen).
Metabolisme
Pentachloorfenol wordt snel na inname in de darm opgenomen. Accumulatie treedt niet snel op. Is dat wel het geval dan is dat in de lever, nieren, gekoppeld aan bloed-eiwitten, de milt en lichaamsvet. Tenzij de lever- en nierfunctie beschadigd zijn wordt PCP snel uit weefsels en bloed verwijderd en uitgescheiden door de nieren. De uitscheiding is voornamelijk als pentachloorfenol of als een beter water-oplosbaar conjugaat. De halfwaardetijd voor een eenmalige dosis is voor mensen tussen de 30 en 50 uur. Accumulatie in de voedselketen wordt niet waarschijnlijk geacht vanwege de tamelijk hoge snelheid van uitscheiding door het organisme.
Voorkomen in het milieu
Pentachloorfenol is aangetoond in een groot aantal natuurlijke bronnen: oppervlaktewater, sediment, regenwater, drinkwater, waterorganismen, aarde en voedsel, maar ook in menselijke melk, vetweefsel en urine.
Tegenwoordig is de milieubelasting met pentachloorfenol kleiner dan in het verleden, enerzijds door de absoluut kleinere hoeveelheden die van de stof gebruikt worden, anderzijds door een aanpassing in de manier van werken met de stof. Niettemin komt er nog steeds PCP in het milieu terecht en ook treedt verplaatsing op via regen, uitlogen van grond of verplaatsing van grond. Ook verdamping vanuit behandeld hout speelt een rol.
Afbraak en meetbaarheid in het milieu
Na het vrijkomen van pentachloorfenol in de atmosfeer vindt ontleding plaats via fotolyse. De biologische afbraak vindt plaats door het verwijderen van de chloriden en door de koolstofring open te breken. De volgorde hiervan is afhankelijk van de omstandigheden. Het verwijderen van de chloriden vindt plaats via reductieve dehalogenering, via methyleren naar het beter vetoplosbare pentachlooranisool, of onder aerobe omstandigheden door hydroxylering. Bij reductieve dehalogenisering wordt pentachloorfenol via tetra- en tri- naar dichloorfenolen omgezet. De verschillende routes kunnen uiteindelijk leiden de volledige afbraak van de verbinding.
In ondiep, helder water is de voornaamste afbraakroute fotolyse. In diep of troebel water vormen biodegradatie en adsorptie aan slib de belangrijkste routes waarlangs pentachloorfenol uit het water verdwijnt. Adsorptie is wel pH-afhankelijk: in zuur milieu is de oplosbaarheid van pentachloorfenol veel kleiner dan in neutrale of basische oplossingen.
In grond en sediment is pentachloorfenol, afhankelijk van de aanwezige bacteriën en de omstandigheden, niet meer meetbaar na een periode die uiteen kan lopen van 14 dagen tot 5 jaar. Polychloorfenol is dan volledig afgebroken of afgebroken tot metabolieten. De metabolieten kunnen zowel minder schadelijk zijn voor het milieu dan pentachloorfenol, als ook schadelijker dan pentachloorfenol. Het niet langer meetbaar zijn van pentachloorfenol in het milieu betekent dat er nog steeds giftige afbraakproducten in het milieu aanwezig kunnen zijn. Om de aanwezigheid van giftige afbraakproducten uit te sluiten, moet een uitgebreide analyse op de vele mogelijk afbraakproducten (metabolieten) worden uitgevoerd. In de regel is daarom eerder te spreken niet langer meetbaar zijn in het milieu, dan over afbraak in het milieu, dat schadeloosheid impliceert.


