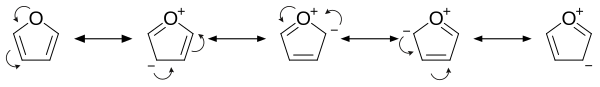Furaan
| Furaan | |||||
|---|---|---|---|---|---|
| Structuurformule en molecuulmodel | |||||

| |||||
|
Structuurformule van furaan
| |||||

| |||||
|
Molecuulmodel van furaan
| |||||
| Algemeen | |||||
| Molecuulformule | C4H4O | ||||
| IUPAC-naam | furaan | ||||
| Andere namen | oxacyclopentadieen, furfuran | ||||
| Molmassa | 68,08 g/mol | ||||
| SMILES |
C1=CC=CO1
|
||||
| InChI |
1/C4H4O/c1-2-4-5-3-1/h1-4H
|
||||
| CAS-nummer | 110-00-9 | ||||
| EG-nummer | 203-727-3 | ||||
| PubChem | 8029 | ||||
| Beschrijving | Heldere vloeistof | ||||
| Vergelijkbaar met | THF | ||||
| Waarschuwingen en veiligheidsmaatregelen | |||||
| |||||
| H-zinnen | H224 - H302 - H315 - H331 - H341 - H350 - H373 - H412 | ||||
| EUH-zinnen | geen | ||||
| P-zinnen | P201 - P210 - P261 - P273 - P281 - P311 | ||||
| Omgang | Damp niet inademen en blootstelling vermijden; koelen alvorens fles voorzichtig te openen. | ||||
| Opslag | Verwijderd houden van hitte, vonken of open vlammen, brandveilig opslaan. | ||||
| LD50 (ratten) | (oraal) 300 mg/kg | ||||
| Fysische eigenschappen | |||||
| Aggregatietoestand | vloeibaar | ||||
| Kleur | kleurloos | ||||
| Dichtheid | 0,9514 g/cm³ | ||||
| Smeltpunt | −85,65 °C | ||||
| Kookpunt | 31,36 °C | ||||
| Vlampunt | −35 °C | ||||
| Dampdruk | 67000 Pa | ||||
| Goed oplosbaar in | aceton, ethanol | ||||
| Slecht oplosbaar in | water | ||||
| Thermodynamische eigenschappen | |||||
|
ΔfH |
−34,8 kJ/mol | ||||
|
ΔfH |
−62,3 kJ/mol | ||||
|
S |
267,2 J/mol·K | ||||
|
S |
177 J/mol·K | ||||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | |||||
| |||||
Furaan is een heterocyclische organische verbinding, met als brutoformule C4H4O. De stof komt voor als een zeer licht ontvlambare kleurloze vloeistof, die slecht oplosbaar is in water. Structureel gezien bestaat de molecule uit een ring van vier koolstofatomen en een zuurstofatoom die, net als bij benzeen, gedelokaliseerde elektronen bevat. Furaan is een aromatische verbinding.
Een veelgebruikte afgeleide van furaan is het gehydrogeneerde tetrahydrofuraan of THF.
Synthese
Furaan kan gevormd worden door de decarboxylering van furfural of de katalytische oxidering van 1,3-butadieen:
Een van de meest eenvoudige methoden is de reactie van 1,4-diketonen met fosforpentaoxide. Deze synthese staat bekend als de Paal-Knorr-synthese.
Een andere mogelijkheid is via de Feist-Bénary-synthese.
Eigenschappen en reacties
Furaan is een aromatische verbinding: het bezit 6 gedelokaliseerde π-elektronen. Hiervan zijn er 4 afkomstig van de 2 dubbele bindingen in de ringstructuur en 2 van het vrij elektronenpaar op zuurstof. De sp2-hybridisatie van het zuurstofatoom laat het immers toe om deel te nemen aan de delokalisatie in de ring.
In elektrofiele substituties is het reactiever dan benzeen, als gevolg van het elektronendonerend effect van het heteroatoom. Dit komt onder meer tot uiting bij het beschouwen van de resonantiestructuren van furaan:
Furaan kan dienen als dieen in een diels-alderreactie met elektronendeficiënte diënofielen, bijvoorbeeld ethyl-(E)-3-nitroacrylaat, zoals in onderstaand geval:
De hydrogenering van furaan leidt aanvankelijk tot vorming van dihydrofuraan en vervolgens tot tetrahydrofuraan.
Toxicologie en veiligheid
Furaan is een ontvlambare vloeistof. Ze is toxisch voor de longen en het zenuwstelsel en irriterend voor de huid, ogen en maag-darmstelsel. Blootstelling aan grote hoeveelheden kan schade aan organen veroorzaken en dodelijk zijn.
Externe links
- (en) MSDS van furaan