
Radicaal (scheikunde)

Een radicaal, ook dikwijls vrije radicaal genoemd, is een molecuul of atoom dat al dan niet geladen kan zijn, maar dat een of meer ongepaard(e) elektron(en) heeft.
Een dergelijke configuratie is energetisch ongunstig en zal makkelijk naar een gepaarde elektronenstructuur overgaan als dit mogelijk is. Stoffen met ongepaarde elektronen zijn dan ook vaak uiterst reactief en het zijn deze radicalen, die aan reacties zullen deelnemen. Radicalen bestaan daarom veelal maar fracties van seconden als tussenproduct/intermediair tijdens reacties. Toch zijn er ook radicalen bekend die stabiel genoeg zijn om als chemische stof geïsoleerd te kunnen worden.
Inhoud
Stabiele radicalen
Een aantal chemische verbindingen bestaat uit radicalen. Dit geldt bijvoorbeeld voor een tweetal oxiden van stikstof: stikstofmonoxide NO en stikstofdioxide NO2 en voor chloordioxide. De in de lucht aanwezige zuurstof is een diradicaal, hoewel er ook een niet-radicale vorm bestaat: singletzuurstof.
Overgangselementen en vooral lanthaniden hebben vaak ongepaarde elektronen, zonder dat dit tot grote reactiviteit leidt. Dit heeft te maken met het feit dat d- en vooral f-elektronen orbitalen bezetten die niet zo goed met die van de buurman overlappen. De grote reactiviteit van organische radicalen is een gevolg van de aard van de betrokken s- en p-elektronen van het element koolstof.
Rol in reacties
Door hun grote reactiviteit kunnen afzonderlijke organische radicalen, in de korte tijd dat ze bestaan, kettingreacties induceren en veranderingen aanbrengen in honderden tot duizenden moleculen. Enkele grotere leden van de groep zijn echter stabieler en ook als zuivere stof te verkrijgen. Het eerste organische radicaal, het trifenylmethylradicaal, werd in 1900 door Moses Gomberg geïdentificeerd.
Radicalen spelen een belangrijke rol in onder andere verbranding, atmosferische chemie, polymerisaties en biochemische processen.
Reactiviteit en stabiliteit van organische radicalen
Normale stabiele toestanden zijn deze waarbij de elektronen evenwichtig verdeeld en gepaard voorkomen in organische moleculen. Is er sprake van een ongepaard elektron dan is dit een in het algemeen zeer reactief radicaal. Stabilisatie kan optreden door:
 Vitamine E of α-tocoferol |
 Radicaal afgeleid van vitamine E of α-tocoferol |
- Delokalisatie
Het principe van delokalisatie van het ongepaard elektron is dat door het uitsmeren van de ongepaardheid naar een naburige dubbele binding of een ernaast liggend stikstof- of zuurstofatoom, zowel het atoom, dat oorspronkelijk het radicaal bevatte, als aan de delokalisatie deelnemende atomen een gedeeltelijk radicaal karakter krijgen. Hierdoor daalt de energie-inhoud van het radicaalmolecuul: het radicaal wordt stabieler en minder reactief. Het radicaal van α-tocoferol, of vitamine E, is een voorbeeld van een door delokalisatie gestabiliseerd radicaal: het karakter van een radicaal is uitgesmeerd over zowel de aromatische ring als beide zuurstofatomen.
- Sterische hindering
Sterische hindering berust erop dat door grote moleculaire groepen rond het gelokaliseerde, of perfect gepositioneerde, radicaal het voor andere moleculen onmogelijk kan worden om het radicaal te naderen en dus met het radicaal te reageren. Hierdoor daalt de effectieve reactiviteit. Zo zijn bijvoorbeeld tertiaire butylgroepen op het radicalair koolstofatoom zeer effectief in het afschermen van de reactiviteit. Voorbeelden hiervan zijn het trifenylmethylradicaal (Gombergs radicaal), kaliumnitrosodisulfonaat (KSO3)2NO• en nitroxides, met als algemene formule R2NO•, zoals tetramethyl piperidinoxyl TEMPO.
| Enkele voorbeelden van radicalen die stabiel zijn door sterische hindering | |
 TEMPO |
 Trifenylmethylradicaal |
Productie van organische radicalen
De vorming van radicalen vereist de homolytische splitsing van covalente bindingen. Een dergelijk proces vereist een grote hoeveelheid energie, thermisch of fotolytisch toegevoegd. Zo is voor de splitsing van waterstofgas H2 in 2 waterstofradicalen H• een enthalpieverandering ΔH° van +435 kJ/mol nodig, terwijl voor de omzetting van Cl2 in 2Cl• een ΔH° van +243 kJ/mol nodig is. Deze energie noemt men de bindingsenergie ΔH°. De bindingsenergie van twee covalent gebonden atomen is afhankelijk van de volledige structuur van de molecule en niet enkel van de identiteit van de twee atomen. Homolytische splitsing treedt het gemakkelijkst op bij atomen met ongeveer dezelfde elektronegativiteit. Stoffen die lichtgevoelig zijn of gemakkelijk radicaalreacties kunnen ondergaan, worden meestal bewaard in donkerbruine glazen flessen. Deze bruine kleur absorbeert grotendeels het licht, zodanig dat het licht geen, of veel moeilijker, radicaalreacties in de fles kan doen ontstaan.
Hoog-energetische elektromagnetische straling, zoals ioniserende straling: bètastraling en gammastraling, zal bij interactie met materie, elektronen losslaan of verbindingen verbreken waardoor radicalen ontstaan. Zonlicht of UV-licht kan reeds verbindingen verbreken tussen twee heteroatomen, dat zijn atomen die geen koolstof of waterstof zijn, bijvoorbeeld in Cl2, Br2, azodiisobutyronitril AIBN en dibenzoylperoxide. Homolytische splitsing van heteroverbindingen is eveneens mogelijk met behulp van een matige temperatuursverhoging. UV-lampen of temperatuurverhoging worden daarom vaak gebruikt voor het maken van radicalen aan de hand van dergelijke heteroverbindingen:
Bij zeer hoge temperaturen zal er bij andere producten eveneens een kleine fractie radicalen ontstaan die in evenwicht is met stabiele moleculen, met allemaal gepaarde elektronen. Deze fractie zal altijd zeer klein zijn. Zo zullen er bij het optreden van hoog-energetische vonken, > 10000 °C, eveneens radicalen ontstaan. Dergelijke vonken kunnen elektrisch worden opgewekt met behulp van zeer hoge potentiaalverschillen, vergelijk het met het ontstaan van donder en bliksem.
Radicalen in chemische reacties
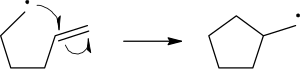
In structuurformule worden de radicalen voorgesteld door een dikke punt. Deze punt wordt geplaatst naast het atoom dat het ongepaarde elektron draagt. Bij radicalaire reacties wordt de beweging van radicaalelektronen door enkele vishaakpijl 
Gelijkenissen en verschillen tussen ionen en radicalen in reacties
- het oplosmiddel heeft geen invloed op de eindproducten of het verloop van radicaalreacties, dit in tegenstelling met ionaire reacties waarbij het oplosmiddel nevenreacties kan versnellen of vertragen
- radicalen reageren normaal niet met elkaar: omdat ze zo reactief zijn reageren ze bijna met elk product in de onmiddellijke nabijheid. Ionen in oplossing kunnen daarentegen wel met elkaar reageren.
- mogelijkheden voor stabilisatie zijn dezelfde voor ionen en radicalen. In organische moleculen verloopt de stabilisatie gelijk aan die van de positief geladen ionen.
Typisch reactieverloop van radicaalreacties
In chemische reacties nemen vrije radicalen deel aan additie- en substitutiereacties. Omdat radicalen alleen bij een toevallige ontmoeting tussen 2 radicalen verdwijnen, geven ze, normaal gezien aanleiding tot kettingreacties, waarbij één radicaal aanleiding geeft tot reacties in honderden tot duizenden moleculen. Dergelijke reacties kunnen dan ook opgesplitst worden in de volgende 3 stadia:
- Initiatie
Initiatiereacties zijn die reacties die resulteren in de netto-vorming van radicalen. De radicalen worden gemaakt uit stabiele producten of via reacties van radicalen met stabiele producten om nieuwe radicalen te produceren.
- Propagatie
Propagatiereacties zijn reacties, waarbij radicalen aan reacties deelnemen, maar het totaal aantal radicalen hetzelfde blijft. Een radicaal induceert een reactie of verandering aan een andere functionele groep, meestal in een andere molecule, terwijl na de reactie een nieuw radicaal wordt gevormd. Zie de reactie hierboven. Door de hoge reactiviteit van het gevormde radicaal, zal deze een nieuwe reactie induceren bij een andere molecule, waardoor een kettingreactie ontstaat. De reacties zijn normaal gezien exotherm. Het evenwicht alsook de aard van de gevormde producten, worden bepaald door het thermodynamisch evenwicht van de aan de reactie deelnemende producten.
- Terminatie
Terminatiereacties zijn reacties die resulteren in een netto-daling van het aantal vrije radicalen. Meestal vormen de radicalen een stabiel reactieproduct, bijvoorbeeld 2Cl• → Cl2. Terminatie kan indirect ook optreden doordat een stabiel radicaal ontstaat dat bijna geen reactiviteit meer vertoont, als gevolg van bijvoorbeeld sterische hindering.
Zie ook het volgende voorbeeld in de figuur. De initiatie I gebeurt thermolytisch met behulp van tBuOCl. In het getoonde voorbeeld is dit tevens het reagens dat gebruikt wordt voor de radicalaire chlorering. De twee propagatiestappen P1 en P2 zijn beide exotherm, zodat de reactie zeker gebeurt zoals in de figuur. Samen geven de propagatiereacties de totaalreactie Σ. Terminatie kan optreden door combinatie van 2 eender welke radicalen die in het mengsel aanwezig zijn. De getoonde reactie is typisch voor een meer selectieve chlorering: tBu is volumineus, waardoor de chlorering selectiever verloopt. Bovendien maakt men gebruik van dergelijke alternatieve reagentia omdat ze veel veiliger in gebruik zijn dan chloorgas.
- Typisch verloop van radicaalreacties (-C(CH3)3 = -tBu)
Inhibitie bij radicaalreacties
Inhibitie bij radicaalreacties kan optreden wanneer of de radicalen reageren met stabiele radicalen óf het radicaal een elektron of een compleet atoom opneemt, het ongepaarde elektron wordt daardoor een gepaard elektron, van een stof die makkelijk stabiele radicalen vormt. Door het toevoegen van een overmaat inhibitor verhoogt men zo de snelheid van de terminatiereacties, waardoor de radicaalreacties stilvallen. Door gebruik te maken van inhibitoren kan men:
- radicaalgevoelige stoffen transporteren
- initiatiereacties bestuderen, omdat de initiële radicalen gevangen worden en bewaard in de toestand waarin ze ontstaan zijn
Voorbeelden van inhibitoren zijn Difenylpicryl hydrazyl DPPH, chinonen en fenolen:

Verbranding: dizuurstof als voorbeeld van een diradicaal
Uit een kwantumchemische benadering van de elektronische structuur van dizuurstof volgt dat deze verbinding eerder kan worden beschouwd als een molecule met twee ongepaarde elektronen, in plaats van een molecule waarbij alle elektronen gepaard zijn. Deze 2 ongepaarde elektronen bevinden zich in de buitenste orbitalen en zijn dus direct beschikbaar voor reacties. De reactiviteit van dit diradicaal is echter beperkt doordat beide een parallelle spin hebben. Voor effectieve radicaalreacties in organismen (voor de ademhaling van het organisme) zijn er dan ook enzymen nodig. Tevens kan ook verhitting, met een vlam, ervoor zorgen dat de activeringsenergie voor radicaalreacties overwonnen wordt. De propagatiereacties geven aanleiding tot omzetting van brandbare organische materialen in CO2 en H2O. De hierbij vrijgekomen warmte zorgt voor een continue aanmaak van verse actieve zuurstofradicalen. Daarmee is verbranding voor verwarming of energieproductie de meest uitgevoerde radicaalreactie. Wanneer het brandbare materiaal verbruikt is, nemen de terminatiereacties weer de overhand en dooft het vuur.
Polymerisatie
Ook bij de productie van vele polymeren of plastics, zoals pvc en polystyreen, zijn vrije radicalen betrokken. Echter, doordat radicalen zelf zeer reactief zijn, reageren ze vooral met de monomeren in de nabijheid van het ontstane radicaal. Bij aanwezigheid van een grote overmaat van monomeer in de onmiddellijke nabijheid van het radicaal, ontstaan lange polymeerketens. Bij aanwezigheid van een eerder beperkte hoeveelheid monomeer ontstaan veel eerder korte ketens. Recente, gepatenteerde ontwikkelingen in radicalaire polymerisaties laten toe om de radicaalreacties te controleren. Deze technieken worden samengevat onder de noemer levende polymerisaties:
- Reversibele Additie-Fragmentatie ketting Transfer, Reversible Addition-Fragmentation chain Transfer of RAFT
- Atoom Transfer Radicaal Polymerisatie, Atom Transfer Radical Polymerization of ATRP
- Nitroxide beMiddelde Polymerisatie, Nitroxide mediated polymerization of NMP
Met behulp van deze technieken ontstaan polymeerketens die veel minder vertakt zijn. Bovendien zijn de geproduceerde ketens veel uniformer met een nauwere spreiding van de moleculaire gewichten.
Atmosferische chemie
Atmosferische chemie is het vakgebied van de chemie die de reacties in de atmosfeer onderzoekt.
Men kan stellen dat de atmosfeer eigenlijk de grootste luchtzuiverende fabriek ter wereld is. Bijvoorbeeld methaan, uitlaatgassen en koolwaterstoffen komen in de atmosfeer terecht. Dergelijke organische stoffen worden in de atmosfeer door radicaalreacties afgebroken. Zuurstofgas O2, ozon O3 en hydroxylradicalen OH• spelen hierbij een centrale rol. Ultraviolette straling, afkomstig van de zon, produceert in de hogere lagen van de atmosfeer voortdurend verse radicalen.
Radicalen afkomstig van de homolytische splitsing van bronmoleculen zoals H2, CH4, chloor-fluor-koolwaterstoffen of CFK’s of freonen hebben een enorme invloed op de evenwichten van de reacties in de atmosfeer.
- Halogeenradicalen Cl•, F• en Br• vernietigen ozon op een katalytische wijze, in de propagatiereactie wordt ozon omgezet in zuurstof:
Bij terminatiereacties verdwijnt het halogeen echter niet en kan zijn vernietigende werking bij een volgende homolytische splitsing gewoon voortzetten.
- Waterstofradicalen H• zijn vooral afkomstig van bijvoorbeeld waterstofgas H2 en methaan CH4. Waarschijnlijk hebben ze vooral een vertragende werking op atmosferische reacties. Waterstofradicalen doen vaak in terminatiereacties mee.
Fotochemische smog of zomersmog
Onder invloed van zonlicht kan uit een mengsel van koolwaterstoffen en stikstofoxiden in de lucht een fotochemische smog ontstaan, een zeer ongezond en oxiderend mengsel met peroxiden en ozon. Dat heet zomersmog.
Radicalen in de biologie
Radicalen spelen een belangrijke rol in tal van biologische processen. Sommige daarvan zijn essentieel voor het leven, zoals bij de productie van bepaalde steroïden. Verder zijn vrije radicalen ook betrokken bij bepaalde processen van impulsoverdracht.
Omdat zuurstof het meest aanwezige radicaal is en vele organismen afhankelijk zijn van zuurstof voor de ademhaling, zijn zuurstofgebaseerde radicalen zoals het superoxide en hydroxylradicaal biologisch gezien het belangrijkst. Echter, deze radicalen zijn zeer reactief. Hierdoor zijn ze bij verschillende nevenreacties zoals DNA-beschadiging en celveroudering betrokken. Ernstigere vormen van DNA-beschadiging leiden tot mutaties die de celcyclus negatief kunnen beïnvloeden en zelfs kanker kunnen veroorzaken. Zo zijn vrije radicalen betrokken bij leverbeschadiging, die door alcohol is veroorzaakt. Verder zijn radicalen in sigarettenrook ook betrokken bij de inactivatie van α-1-antitripsine in de longen. Dit proces bevordert de ontwikkeling van emfyseem.
Antioxidanten en bescherming tegen radicalen
Omdat radicalen nodig zijn voor levende wezens om te leven, hebben deze een aantal mechanismen ontwikkeld om celbeschadiging te repareren en om de schadelijke invloed van radicalen te minimaliseren. Enzymen zoals superoxidedismutase, katalase, glutathionperoxidase en glutathionreductase zijn zo zeer belangrijk voor de celbescherming. Deze enzymen hebben mineralen als seleen, zink, mangaan en koper nodig als co-enzym voor hun werking.
Verder spelen ook antioxidanten een sleutelrol bij deze beschermingsmechanismen. Antioxidanten die men vaak aantreft bij organismen zijn bijvoorbeeld de retinol (vitamine A), ascorbinezuur (vitamine C) en tocoferolen (vitamine E). Hun werking bestaat erin dat ze gemakkelijk geoxideerd kunnen worden tot radicalen, terwijl de radicaalvorm stabiel is. Bovendien bestaan er goede aanwijzingen om aan te nemen dat bilirubine en urinezuur tevens fungeren als antioxidantia en zo radicalen neutraliseren. Bilirubine komt vrij bij de afbraak van rode bloedcellen, terwijl urinezuur vrijkomt bij de afbraak van purines en bij sommige dieren van eiwitten.
Radicalen en voeding
Het rans worden van boter is te wijten aan radicalaire oxidatie aan de vinylische plaatsen van de vetzuurketens. Hierdoor verkleurt de boter en verandert hij van smaak.
Het zuur worden van wijn is te wijten aan een trage oxidatie van de ethanol, of alcohol, naar ethanal. Vervolgens treedt een radicalaire oxidatie op waarbij de waterstof van de aldehydegroep wordt vervangen en waarbij een zuurperoxide ontstaat. Dit zuurperoxide is in staat om zowel radicalen te vormen door homolytische splitsing, als om ethanol tot ethanal en ethanal tot azijnzuur te oxideren.
Diverse fabrikanten verkopen voedingssupplementen met antioxidantia.
Diagnostische technieken
Technieken die gebruikt worden bij het onderzoek naar radicalen zijn onder andere:
- Elektron Spin Resonantie spectroscopie: ESR spectroscopie is een vaak gebruikte techniek voor het bestuderen van vrije radicalen en andere paramagnetische moleculen. Deze techniek wordt soms ook elektron paramagnetische resonantie spectroscopie genoemd en is gerelateerd met kernspinresonantie.
- Kernspinresonantie of NMR spectroscopie, met behulp van fenomenen zoals CIDNP
- Chemische merking: chemische merking van radicalen met andere stabiele radicalen zoals stikstofoxide of difenylpicrylhydrazyl DPPH, gevolgd door respectievelijk spectroscopische analyse met X-straal foto-elektron spectroscopie (XPS) of absorptie spectroscopie.
Toepassingen
- Bleekloog: bleekwater is een waterige oplossing van natriumhypochloriet NaOCl (v) → Na+(aq) + OCl−(aq). Onder invloed van zonlicht ontstaan chloorradicalen en zuurstofradicalen. Deze radicalen hebben zowel een blekende werking, ze breken pigmenten en organische stoffen gedeeltelijk of volledig af, als een ontsmettende werking, de celwanden van micro-organismen worden geoxideerd of opengebroken.
- Halogenering van alkanen: met behulp van Cl2 of Br2 wordt een halogeenfunctionaliteit ingevoerd. Dit is zowat de enige methode om een functionele groep in te voeren op zuivere koolwaterstoffen. Dit zijn de producten die alleen uit koolstof en waterstof bestaan.
- Aanmaak van peroxiden
- Productie van fenol en aceton uit cumeen en zuurstof
- Thermisch kraken van koolwaterstoffen: productie van nafta, door middel van katalysatoren en kortstondige verhitting.
Literatuur
- (en) Streitweiser, Andrew, Clayton H., Heathcock; Edward M., Kosower, Introduction to organic chemistry, Fourth Edition. Prentice Hall Inc (1998). ISBN 0-13-973850-9.
- (en) Solomon, Eldra Pearl, Linda, R. Berg; Diana W., Martin, Biology, 5th edition. Saunders college publishing (1999). ISBN 0-03-022299-0.
| Bronnen, noten en/of referenties |



![{\displaystyle {\begin{array}{llcl}{\text{I:}}&{\ce {(CH3)3C-O-Cl}}&{\ce {->[\Delta ]}}&{\ce {(CH3)3C-O}}^{*}{\ce {+Cl}}^{*}\\{\text{P}}_{1}{\text{:}}&{\ce {R-H}}{\ce {+(CH3)3C-O}}^{*}&{\ce {<=>>}}&{\ce {R}}^{*}{\ce {+(CH3)3C-OH}}\\{\text{P}}_{2}{\text{:}}&{\ce {R}}^{*}{\ce {+(CH3)3C-O-Cl}}&{\ce {<=>>}}&{\ce {R-Cl}}{\ce {+(CH3)3C-O}}^{*}\\\hline \Sigma &{\ce {R-H}}{\ce {+(CH3)3C-O-Cl}}&{\ce {->[{\text{40 °C}}]}}&{\ce {R-Cl}}{\ce {+(CH3)3C-OH}}\end{array}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/13a15cac8e4938b6825fe9d08388a44f8e9d38f0)
