
Nitrosamine
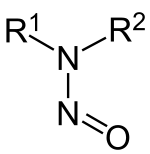
Nitrosamines, nitraminen of N-nitrosoverbindingen zijn een klasse van organische verbindingen met de algemene formule R1R2N-NO. Onder bepaalde omstandigheden (zuur milieu, hoge temperatuur) kunnen deze verbindingen uit nitriet en amines worden gevormd. De meeste leden van deze chemische familie hebben een carcinogene werking.
Door de hoge carcinogene potentie en het frequente voorkomen zijn de nitrosamines de best bestudeerde klasse chemische carcinogenen.
Inhoud
Geschiedenis
Ontdekking
Nitrosamines werden in 1883 ontdekt door Antoine Franchimont (1844–1919), hoogleraar organische chemie aan de Universiteit van Leiden. Na een publicatie van de twee Britse wetenschappers John Barnes en Peter Magee in 1956 over de vorming van levertumoren na blootstelling aan dimethylnitrosamine begon het onderzoek naar de carcinogeniciteit van N-nitrosoverbindingen. Meer dan 90% van de rond 300 onderzochte verbindingen bleek carcinogeen in verschillende proefdieren.
In de jaren 1970 en 1980 werd het door de ontwikkeling van betrouwbare analysemethodes mogelijk om het nitrosaminegehalte in voedsel en drank te bepalen. Ondanks dat er door incidenten met dimethylnitrosamine in vismeel (begin van de jaren 1970) en door hoge concentraties nitrosamines in gepekeld vlees (eind van de jaren 1970) duidelijk aanwijzing bestond voor een relatie tussen N-nitrosoverbindingen en het ontstaan van kanker, zijn de wettelijke beperkingen wereldwijd bijna verwaarloosbaar. Zo heeft de Amerikaanse Environmental Protection Agency (EPA) N-nitrososamines maar als 'mogelijk carcinogeen in de mens' geclassificeerd. In de IARC-classificatie zijn de verbindingen dimethyl- en di-ethylnitrosamine opgenomen in categorie 2A (waarschijnlijk humane carcinogenen). Vooral politieke interesses van de verschillende industrieën maken het mogelijk dat over de gevolgen van blootstelling aan nitrosaminen op lange termijn nog steeds weinig bekend is.
Incidenten
De eerste wetenschappelijk aangetoonde vergiftiging met nitrosamines gebeurde 1964. Hierbij zijn in Noorwegen een groot aantal schapen overleden aan levertumoren, nadat ze voer hadden gekregen waaraan nitrietzouten en amines waren toegevoegd als conserveringsmiddelen. In de kadavers werden hoge concentraties N-nitrosoverbindingen aangetoond.
In de jaren 80 zijn N-nitrosoverbindingen als kankertherapeutica gebruikt, bijvoorbeeld semustine (CNU) en procarbazine (PCZ). In epidemiologische studies met betrekking tot deze geneesmiddelen zijn voor het eerst overtuigende aanwijzingen op carcinogene effecten van nitrosamines op de mens gevonden.
Humane carcinogeniciteit
Data met betrekking tot de carcinogeniciteit van N-nitrosoverbindingen is verregaand afkomstig uit proefdieronderzoek. Hoewel dit indicatie is voor een carcinogene werking ook in de mens, zijn nog geen algemeen aanvaarde bewijzen hiervoor voorgelegd. Uit verschillende studies en incidentanalyses blijkt echter een carcinogene werking van enkele N-nitrosoverbindingen ook in de mens. Gezien het feit dat de metabole routes zeer vergelijkbaar zijn en soortgelijke reactieve metabolieten involveren leiden sommige wetenschappers hier een algemeen carcinogeen effect op de mens uit af. Een analyse van een groot aantal epidemiologische studies van de afgelopen jaren met betrekking tot de gastro(GC)- en oesofagocarcinogene (OC) effecten van nitriet- en nitrosamine opname heeft een positieve associatie voor GC en onvoldoende bewijsmateriaal voor OC vastgesteld.
Voorbeelden
| triviaalnaam | IUPAC-naam | structuur |
|---|---|---|
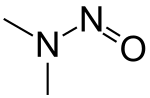
| Dimethylnitrosamine (NDMA) | N,N-dimethylnitrous amide |
|
| Diethylnitrosamine (NDEA) | N,N-diethylnitrous amide |

|
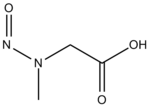
| Nitrosarcosine | 2-[methyl(nitroso)amino]acetic acid |
|
| Nitrosopyrrolidine | 1-nitrosopyrrolidine |

|
| Nitrosopiperidine | 1-nitrosopiperidine |

|
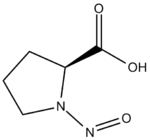
| Nitrosoproline | 1-nitrosoproline |
|
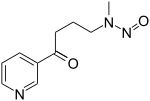
| Nicotine-derived nitrosamine ketone (NNK) | 4-(methylnitrosamino)- 1-(3-pyridyl)-1-butanone |
|
| N-nitrosonornicotine (NNN) | 3-(1-Nitrosopyrrolidin-2-yl)pyridine |

|
Vorming en biotransformatie
Endogene vorming
Onder zure omstandigheden – bijvoorbeeld in de maag – worden nitrosamines gevormd uit nitriet en amines.
- Nitriet wordt door protonatie omgezet in salpeterig zuur
- Herhaalde protonatie leidt tot splitsing in nitrosyl en water
- Het nitrosyl reageert vervolgens met een secundair amine tot een N-nitrosoverbinding.
 (1)
(1)  (2)
(2) (3)
(3)Exogene vorming
De reactie van nitriet met secundaire amines tot N-nitrosoverbindingen kan ook aflopen bij hoge temperatuur. Deze route is voornamelijk significant voor de opname via voeding (zie Blootstelling) en het roken van tabak.
Bioactivering
De toxische werking van N-nitrosamines is gebaseerd op de bioactivering door het enzym cytochroom P450 (CYP450). Dit enzym initieert het metabolisme van de nitrosoverbinding door α-carbon hydroxylatie en vervolgens dealkylering.
In het vervolg wordt zowel een alkylerend carbeniumion als een reactief aldehyde gevormd (zie reactieschema), dat voornamelijk DNA, maar ook proteïnen kan acetyleren.
Andere metabolieten, zoals hydrazines, spelen een minder belangrijke rol in de toxiciteit, maar zijn wel aanwezig en worden via verschillende routes gevormd.
Detoxificatie
De ontgifting van N-nitrosamines wordt eveneens gecatalyseerd door CYP450 en is competitief met het mechanisme voor dealkylering en vorming van het carbeniumion. Hierbij wordt nitriet afgesplitst wat de vorming van het carcinogene diazoniumion voorkomt.
Bovendien kunnen nitrosamines en hun elektrofiele alkylerende metabolieten zoals carbeniumionen door conjugering met a) glutathione via het enzym glutathione-S-transferase (GST) of b) glucuronide via UDP-glucuronosyltransferase (UDPGT) onschadelijk worden gemaakt.
Mechanisme van toxiciteit
Carcinogene werking
De sterk carcinogene werking van nitrosamines, die voor 90% van alle in proefdieren geteste N-nitrosoverbindingen is vastgesteld, is een gevolg van de metabole vorming van het reactieve carbeniumion, een sterk alkylerend reagens. Dit elektrofiele ion reageert met de elektronenrijke atomen van DNA-basen. Alkylering vindt voornamelijk plaats aan de O6- en N7-posities van guanine en kan tot verschillende effecten leiden:
Vooral methylering van de O6-positie beïnvloedt de paringseigenschappen van guanine met zijn complementaire base cytosine en verstoort daarbij de O6-waterstofbrug.
Dit kan als gevolg van DNA-repair-mechanismen tot een G-C 
Bovendien kan alkylering leiden tot ontwinding of crosslinking van DNA en zodoende tot verstoring van cellulaire transcriptie- en replicatiemechanismen. Worden hierbij tumorsuppressorgenen beschadigd of genen die betrokken zijn bij de regulatie van celgroei- en celdelingprocessen, kan zo eveneens een carcinogeen effect optreden.
Uit recent onderzoek is verder de potentie van N-nitrosoverbindingen gebleken RNA te acetyleren. Omdat de regulatie van celproliferatie en -differentiatie niet alleen op het niveau van transcriptie plaatsvindt maar voor het grootste gedeelte op niveau van translatie, zouden de acetyleringseigenschappen t.o.v. RNA een tweede belangrijke factor in carcinogenese door nitrosamines kunnen zijn.
Acute toxiciteit
Overmatige alkylering van het DNA kan ook direct tot celdood via apoptose (geprogrammeerde celdood) of necrose (niet-intentieuze celdood) leiden. Herkenning van sterke beschadiging van het genetisch materiaal door cellulaire regulatie-enzymen heeft apoptose tot gevolg, terwijl schade in essentiële genen ook necrose kan veroorzaken door bijvoorbeeld de ATP-huishouding te verstoren. Acute toxiciteit kan ook worden veroorzaakt door vorming van adducten met proteïnen via carbeniumion-gemedieerde alkylering of proteïnebinding van de nitrosamines via andere reactieve groepen of andere reactieve metabolieten.
Orgaanspecificiteit
Beschadiging van weefsel door eenmalige of chronische blootstelling is gevonden in voornamelijk de lever en de nier, maar ook in long, CZS, pancreas, mondholte en oesofagus. In de voornamelijk betrokken weefsels (lever, nier, long) is telkens hoge activiteit van cytochroom P 450-mono-oxygenases aangetoond. Dit bevestigt de belangrijke rol van het metabolisme in het mechanisme van carcinogeniciteit van N-nitrosoverbindingen.
Opmerkelijk is dat een groot aantal nitrosamines afhankelijk van aard/tijdsduur van blootstelling en species onderzocht reactie met een specifiek orgaan laat zien, vaak onafhankelijk van de route van blootstelling. Dit is te wijten aan de verschillende verdeling van identieke celltypes in verschillende organismen en de celltype-specifieke activiteit van CYP-mono-oxygenases.
De hoge lipofieliciteit van een groot aantal nitrosamines is verantwoordelijk voor de onafhankelijkheid van toxiciteit van de toedieningsroute. Als lipofiele verbindingen kunnen deze door celmembranen diffunderen en zich in nagenoeg gelijke concentraties over het hele lichaam verspreiden. De toxische werking is dus voornamelijk afhankelijk van de metabole route, die leidt tot bioactivering, maar wordt ook bevorderd door hoge delingsactiviteit (stamcellen) en de mogelijkheid om deze functie te induceren (bijvoorbeeld pulmonaire neuroendocriene cellen). Voor de minder lipofiele nitrosamines en verbindingen met zeer instabiele tussenproducten vindt echter geen gelijke verdeling over het lichaam plaats en geldt deze relatie vervolgens niet. In deze gevallen is de route van toediening uiteraard beslissend voor tumorvorming.
Blootstelling
Door de mogelijkheden van exogene en endogene vorming van nitrosamines dienen twee blootstellingsroutes te worden onderscheiden: de opname van nitriet, waarbij endogeen nitrosamines kunnen ontstaan, en de opname van pregeformde N-nitrosoverbindingen.
Nitriet
Nitrieten worden voornamelijk opgenomen via de voeding. Ze komen voor in levensmiddelen die met nitrietzouten (bijvoorbeeld natriumnitriet (NaNO2) of kaliumnitriet (KNO2)) houdbaar zijn gemaakt zoals vlees, vis en kaas. Het is dan ook niet verstandig om nitrietrijke groenten samen met eiwitrijke vleessoorten op te nemen.
In de afgelopen 50 jaar zijn wettelijke maatregelen genomen om de endogene vorming van nitrosaminen tegen te gaan door de nitrietopname te beperken. Zo mogen aan vleesproducten nog maar 50–250 mg/kg nitrietzouten worden toegevoegd.
Bovendien kan endogene nitrosamine-vorming tegen worden gegaan door aan nitraatrijke voedingsmiddelen antioxidanten zoals vitamine C toe te voegen. Antioxidanten reageren met reactieve intermediairen en voorkomen op deze wijze schadelijke effecten door de vorming van nitriet en N-nitrosoverbindingen. In verband met deze kankerpreventiemaatregelen is de concentratie nitrosamines in producten zoals gebraden vlees van soms meer dan 100ppb gedaald naar <10ppb.
Pregevormde N-nitrosoverbindingen
Exogeen gevormde nitrosamines zijn in een groot aantal producten aanwezig. De hoofdopnameroutes zijn voeding, sigarettenrook en werkomgeving. Toxicologisch het meest belangrijk zijn de nitrosamines in tabak (NNN, NNK). Ze worden ook gevonden in condooms, luchtballons en latex-matrassen, echter blijkt uit verschillende studies dat de blootstelling via latexproducten niet van toxicologisch belang is. Ook in voedsel zijn N-nitrosoverbindingen aangetoond. Deze ontstaan in nitriet- en eiwitrijke producten zoals vlees, vis, kaas en spinazie door binding van nitriet aan aanwezige eiwitten, wanneer deze producten onder hoge temperaturen worden verwarmd, bijvoorbeeld bij het braden, bakken en roken. Verder zijn ook in bier geringe hoeveelheden aangetoond, die weliswaar volgens recente inschattingen te laag (~0,4ppb) zijn voor enige epidemiologische relevantie.
De concentratie waarbij geen duidelijk meer aan te wijzen carcinogeen effect bestaat, ligt rond de 1-5 ppm. De dagelijkse opname van een doorsneeconsument ligt duidelijk onder deze grens (~1.10 μmol/dag) waardoor de mogelijke negatieve effecten door continue blootstelling moeilijk in te schatten zijn. Vooral gepekeld vlees, groenten, melk en melkproducten, tabakproducten, bier en rubberproducten zijn bekende factoren waar de mens dagelijks aan wordt blootgesteld.
Tabak-specifieke nitrosamines
Tabak-specifieke nitrosamines worden gevormd door een nitrosatiereactie van nicotine en gerelateerde verbindingen tijdens de processing. Deze verbindingen zijn sterk carcinogeen en horen bij de gevaarlijkste stoffen in sigarettenrook. De meest bekende tabaksspecifieke nitrosamines zijn 4-(methylnitrosamino)-1-(3-pyridyl)-1-butanone (NNK) en N'-nitrosonornicotine (NNN). Voor NNK en de metaboliet hiervan, 4-(methylnitrosamino)-1-(3-pyridyl)-1-butanol (NNAL), is in proefdierexperimenten met ratten aangetoond dat ze als carcinogene factor voor longkanker een behoorlijke rol spelen. Verder is uit proefdierexperimenten met hamsters, muizen en ratten gebleken dat vooral NNN in combinatie met NNK maatgevende invloed heeft op de vorming van kanker in de long, pancreas, mondholte en de oesofagus.
Het precieze metabolisme van de genoemde nitrosaminen en de binding aan DNA via adduct forming in de mens als uitgangspunt voor de vorming van kanker is nog niet geheel duidelijk, wat vooral met de diversiteit onder de individuen te maken heeft die heel anders op blootstelling aan NNK en NNN reageren.
Proefdieronderzoek
In nagenoeg alle proefdierspecies komt de carcinogene werking van de verschillende nitrosamines duidelijk ter uiting. Desondanks zijn duidelijke verschillen in de lokalisatie van de zich ontwikkelende tumoren aan te wijzen, afhankelijk van de proefdierspecies en het gebruikte nitrosamine.
Vooral de structuur-carcinogeniteit-relatie van de nitrosamines is een opvallende factor. Zo kan het wel of niet voorkomen van een extra stikstofatoom het verschil maken tussen de vorming van levertumoren of tumoren van de slokdarm.
Een dosis van 45 μmol/week van NDMA leidt in ratten gemiddeld binnen 31 dagen tot het overlijden als gevolg van levertumoren. De blootstelling aan 44 μmol/week van NDEA leidt tot de vorming van tumoren van de oesofagus en de lever en heeft een nog sterker ingekorte levensduur van gemiddeld 26 dagen ten gevolge. Naast de tumoren of de lever en de oesofagus zijn in ratten afhankelijk van het toegediende nitrosamine tumoren van de maag, de longen, de nieren, de blaas en de neus- en mondholte te vinden.
In tegenstelling tot proefdierexperimenten in ratten is bij experimenten met hamsters in geen enkel geval het optreden van tumoren van de oesofagus of de nieren opgetekend. Opvallend zijn de resultaten uit een onderzoek van Lijinsky uit 1992 waarin de werking van voornamelijk NDMA en NDEA op proefdiermodellen van alle dierklassen is uitgevoerd. Hieruit wordt duidelijk dat nitrosamines in nagenoeg alle dierklassen uitgangspunt voor de vorming van levertumoren zijn, gevolgd door tumoren van de oesofagus, de neusholte en de nieren.
In proefdieren is verder aangetoond dat door middel van inhibitie van CYP-mono-oxygenases en aminemono-oxygenases de carcinogeniteit van nitrosamines sterk kan worden verlaagd.
Bovendien worden nitrosamines vaak in onderzoek naar kanker in proefdieren gebruikt vanwege hun eigenschappen om in een species orgaanspecifieke tumoren te induceren, onder meer onafhankelijk van de toedieningsroute.
Externe links
- Oregon State University, Linus Pauling Institute article on Nitrosamines and cancer, including info on history of meat laws
- Risk factors in Pancreatic Cancer
| Bronnen, noten en/of referenties |

