
Zinkvinger


Een zinkvinger is een structuurmotief in eiwitten met een zinkion (Zn2+). Het zinkion stabiliseert de eiwitvouwing. De polypeptideketen vormt door het zinkion een lusvormige structuur: de zogenoemde zinkvinger, die een specifieke wisselwerking kan hebben met het DNA of RNA. De zinkvinger werd in 1985 door Aaron Klug ontdekt bij de transcriptiefactor IIIA in de oöcyten van de klauwkikker (Xenopus laevis). Gedacht werd dat de DNA-bindingslus gevormd door de donor-acceptorbinding van de liganden vingers vertegenwoordigden, vandaar de naam zinkvingers.
Sinds de ontdekking en opheldering van de zinkvingerstructuren blijken ze alomtegenwoordig te zijn. Zo komen ze bijvoorbeeld voor bij 3% van de menselijke genen.
De zinkvingereiwitmotieven zijn hoofdzakelijk aan DNA bindende eiwitmotieven. Daarom zijn het meestal transcriptiefactoren. Ook zijn er RNA-bindende zinkvingereiwitten bekend. Tot de zinkvingereiwitmotieven behoren echter ook receptoren voor steroïdhormonen.
Bouw
Zinkvingereiwitten hebben ten minste een zinkvingereiwitmotief, dat zich om een centraal zinkion vouwt. Hierbij vormt het zinkion door zijn volle d-orbitaalschil sterke wisselwerkingen met de zwavel-, stikstof- of zuurstofatomen van de aminozuurresten (meestal cysteïne en histidine). Hierdoor ontstaat een tetraedrische donor-acceptorbinding. Het zinkion is er ook verantwoordelijk voor, dat relatief kleine delen van een polypeptidebinding zo gestabiliseerd worden, dat zij een wisselwerking met de nucleïnezuren kunnen aangaan. Daar zink maar één stabiel oxidatieniveau heeft, kan het in de cel geen ongewenste reacties katalyseren.
Bij een transcriptiefactor bindt de eiwitlus, die in het midden telkens twee cysteïne- en twee histidineresten rond het centrale Zn2+-ion heeft (Cys2His2-zinkvingereiwit), aan een bepaalde base van de grote groeve van de DNA-dubbele helix. Zinkvingereiwitten kunnen ook uit vier of zes zinkbindende cysteïne-resten bestaan (Cys4- respectievelijk Cys6-zinkvingereiwit).
Het zinkvingereiwitmotief bestaat altijd uit een donor-acceptorbindingsequentie, die per soort zinkvingereiwitmotief verschillend kan zijn.
Structuren
De volgende tabel toont verschillende zinkvingerstructuren met hun kenmerkende eigenschappen:
| Vouwingsgroep | Representatieve structuur | Plaats ligand |
|---|---|---|
| Cys2His2 |  |
Twee liganden vormen een gewricht (knuckle) en de andere twee liganden vormen de C-terminus van een helix. |
| Gag knuckle |  |
Twee liganden vormen een gewricht en de andere twee liganden vormen een korte helix of lus. |
| Treble clef |  |
Twee liganden vormen een gewricht en de andere twee liganden vormen de N-terminus van een helix. (In de vorm van een vioolsleutel) |
| Zinc ribbon | 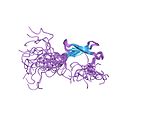 |
Twee liganden vormen twee gewrichten. |
| Zn2/Cys6 | 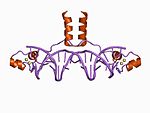 |
Twee liganden vormen de N-terminus van een helix en de andere twee liganden vormen een lus. |
| TAZ2-eiwitmotief-achtig |  |
Twee liganden vormen de termini van twee helices. |
| Short zinc‐binding loops | Korte zinkbindingslussen, die voorkomen in de grotere eiwitten en beschouwd kunnen worden als kleine, afzonderlijke eiwitmotieven. Ze bestaan ten minste uit drie liganden, die in de betreffende sequentie dicht bij elkaar liggen en geen deel uitmaken van de secundaire structuurelementen. | |
| Metallothioneïnen |  |
Bèta-E-eiwitmotief van gewone tarwe. Ec-1-metallothioneïne gebonden aan zinkionen. Cysteïnen in geel, zink in paars. |
| Bronnen, noten en/of referenties |