Nitrobenzeen
| Nitrobenzeen | |||||
|---|---|---|---|---|---|
| Structuurformule en molecuulmodel | |||||

| |||||
|
Structuurformule van nitrobenzeen
| |||||

| |||||
|
Molecuulmodel van nitrobenzeen
| |||||

| |||||
|
Fles met nitrobenzeen
| |||||
| Algemeen | |||||
| Molecuulformule | C6H5NO2 | ||||
| IUPAC-naam | nitrobenzeen | ||||
| Andere namen | mononitrobenzeen | ||||
| Molmassa | 123,11 g/mol | ||||
| SMILES |
C1=CC=C(C=C1)[N+](=O)[O-]
|
||||
| CAS-nummer | 98-95-3 | ||||
| EG-nummer | 202-716-0 | ||||
| Waarschuwingen en veiligheidsmaatregelen | |||||
| |||||
| H-zinnen | H301 - H311 - H331 - H351 - H361 - H372 - H411 | ||||
| EUH-zinnen | geen | ||||
| P-zinnen | P261 - P273 - P280 - P301+P310 - P311 | ||||
| MAC-waarde | 5 mg/m³ | ||||
| LD50 (ratten) | (peroraal) 640 mg/kg | ||||
| Fysische eigenschappen | |||||
| Aggregatietoestand | vloeibaar | ||||
| Kleur | geel-groen | ||||
| Dichtheid | 1,205 g/cm³ | ||||
| Smeltpunt | 5,7 °C | ||||
| Kookpunt | 211 °C | ||||
| Vlampunt | 88 °C | ||||
| Zelfontbrandings- temperatuur | 480 °C | ||||
| Dampdruk | 20 Pa | ||||
| Oplosbaarheid in water | 1,9 g/L | ||||
| Matig oplosbaar in | benzeen, ethanol, di-ethylether | ||||
| Slecht oplosbaar in | water | ||||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | |||||
| |||||
Nitrobenzeen is een organische verbinding met als brutoformule C6H5NO2. De stof komt voor als een naar amandel ruikende, geel-groene vloeistof, die slecht oplosbaar is in water. Nitrobenzeen is de eenvoudigste aromatische verbinding waarbij één nitrogroep aan de benzeenring is gekoppeld. Nitrobenzeen werd voor het eerst gesynthetiseerd door Eilhard Mitscherlich.
Inhoud
Synthese
Nitrobenzeen kan gesynthetiseerd worden door benzeen een aromatische nitrering. Daartoe wordt een mengsel bereid van salpeterzuur en zwavelzuur (zogenaamd nitreerzuur), waardoor een oplossing van het nitroniumion (NO2+) ontstaat:
Dit mengsel wordt toegevoegd aan benzeen en door een elektrofiele aromatische substitutie wordt een waterstofatoom op aromatisch ring vervangen door een nitrogroep:
De synthese kan gemakkelijk in het laboratorium worden uitgevoerd met een drienekkolf, waarbij benzeen voorzichtig aan het nitreermengsel wordt toegedruppeld met een druppeltrechter. Aan het einde van de reactie drijft het gevormde nitrobenzeen boven op het nitreermengsel en kan het afgescheiden worden met een scheitrechter. In de industrie wordt ruwweg dezelfde productiemethode toegepast omdat deze relatief goedkoop is.
Eigenschappen en reacties
De nitrogroep zorgt ervoor dat de benzeenring relatief inert wordt ten opzichte van de meeste elektrofielen. Verdere elektrofiele aromatische substitutie zal daardoor pas plaatsvinden onder nog drastischere omstandigheden. Nitrering van nitrobenzeen zal hoofdzakelijk (ongeveer 93%) 1,3-dinitrobenzeen gevormd worden, omdat de nitrogroep het intermediair Meisenheimercomplex destabiliseert wanneer substitutie op de ortho- of para-plaats plaatsgrijpt:
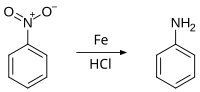
Door de reductie van de nitro-groep met een nikkel-katalysator en waterstof kan aniline worden verkregen. Een andere methode is reductie met waterstofchloride over een ijzerkatalysator:
Het kan ook gereduceerd worden met tin(II)chloride.
Toepassingen
Nitrobenzeen is een belangrijke grondstof bij de synthese van verscheidene organische verbindingen zoals aniline, benzidine, 1,3,5-trinitrobenzeen, 2,4-dinitrofenylhydrazine en chinoline. Ook zijn talloze derivaten bekend, die uiteenlopende toepassingen bezitten. Hooggenitreerde derivaten, zoals 2,4,6-trinitrotolueen (TNT), 2,4,6-trinitrofenol (picrinezuur) en triaminotrinitrobenzeen (TATB), doen dienst als explosief.
Soms wordt nitrobenzeen vanwege zijn hogere inertheid ook als oplosmiddel voor Friedel-Craftsacyleringen gebruikt.
Toxicologie en veiligheid
Nitrobenzeen is een zeer toxische vloeistof (onder meer voor de nieren, longen, de lever, het bloed en de slijmvliezen) en wordt ervan verdacht kanker te kunnen veroorzaken (carcinogeen). Het wordt zeer snel geabsorbeerd door de huid. De vloeistof is irriterend voor de ogen, de huid en de luchtwegen. Blootstelling aan nitrobenzeen kan hoofdpijn, duizeligheid, hartslagverhogingen en braakneigingen veroorzaken.
Externe links
-
 International Chemical Safety Card van nitrobenzeen
International Chemical Safety Card van nitrobenzeen
- (en) MSDS van nitrobenzeen
- (en) Gegevens van nitrobenzeen in de GESTIS-stoffendatabank van het IFA